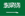La lettera di avvertimento della FDA di Sigelei è un segno di cose a venire
2022-04-16
Il Centro FDA per i prodotti del tabaccoha emesso una lettera di avvertimento14 febbraio a Sigelei Vape per i prodotti venduti senza autorizzazione. La lettera sembra essere il primo avviso emesso a un produttore cinese dal 9 settembre 2021, quando il CTPha posto fine a un anno di non applicazionecontro i produttori che vendono prodotti di vaporizzazione senza l'autorizzazione della FDA.
I prodotti specificamente citati nella lettera di avvertimento sono il Sigelei Humvee 80 (un mod da 80 watt) e il Sigelei 213 Fog Coil. La FDA rileva inoltre che le regole violate dalla vendita di questi due prodotti possono applicarsi anche ad altri prodotti venduti dall'azienda.
La lettera Sigelei è stata discussa da alcuni nel settore dello svapo come un segnale che il CTP è destinato a reprimere le società cinesi. Ma non è necessariamente così. Sigelei si è impegnata in alcune attività che potrebbero distinguerli dalla maggior parte dei produttori di hardware cinesi.
La lettera sanziona Sigelei per aver offerto prodotti in vendita negli Stati Uniti che facevano parte di un'applicazione Sigelei Premarket Tobacco Application (PMTA) che è stata respinta dalla FDA senza revisione. A Sigelei è stata emessa una determinazione Rifiutato di accettare, il che significa che l'applicazione non aveva i requisiti più elementari per passare alla fase successiva della revisione.
"La FDA ha ricevuto la tua domanda di prevendita per i prodotti del tabacco (PMTA) assegnata a STN PM0001221 il 7 settembre 2020", afferma la lettera di avvertimento. "Tuttavia, il 5 febbraio 2021 la FDA ha emesso un'azione negativa per PMTA STN PM0001221 sotto forma di determinazione Rifiuta di accettare che copre sei prodotti. Come discusso in precedenza, i nuovi prodotti del tabacco che non hanno l'ordine di autorizzazione all'immissione in commercio richiesto dalla FDA in vigore, compresi i prodotti ENDS coperti da PMTA STN PM0001221 che hanno portato a una determinazione Rifiutato di accettare, sono adulterati e contrassegnati erroneamente.â€
La discrezione di applicazione di un anno data alla maggior parte dei produttori che hanno presentato PMTA richiedeva che le loro domande fossero accettate per un'ulteriore revisione. Qualsiasi decisione negativa presa dalla FDA dopola scadenza per la presentazione del PMTA del 9 settembre 2020(incluso Rifiutare di accettare) richiede al produttore di interrompere immediatamente la vendita del prodotto in questione o di affrontare l'imposizione. I prodotti Sigelei avrebbero dovuto essere ritirati dal mercato non appena il PMTA dell'azienda fosse stato rifiutato il 5 febbraio 2021.
"Tutti i nuovi prodotti del tabacco sul mercato senza l'autorizzazione pre-commercializzazione richiesta per legge sono commercializzati illegalmente e sono soggetti ad azioni esecutive a discrezione della FDA", scrive la FDA a Sigelei. "I prodotti per i quali non è stata presentata alcuna domanda, inclusi, ad esempio, quelli con un ordine di rifiuto di marketing e quelli per i quali non è stata presentata alcuna domanda, sono tra le nostre massime priorità di applicazione."
Sigelei ha continuato a vendere quei prodotti senza un PMTA in sospeso per più di un anno, il che rende l'azienda un obiettivo della FDA. Ma, ancora peggio, e probabilmente ancora più stimolante per i funzionari della FDA, è un grafico audace sul sito Web di Sigelei (vedi sopra) che chiama l'Humvee 80 e il dispositivo 213 Fog "PMTA SAFE", con il logo FDA sullo sfondo e un segno di spunta verde grasso. La grafica è come sventolare una bandiera rossa in faccia all'agenzia di regolamentazione.
Il fatto che la FDA sia finalmente riuscita a dare seguito a un produttore di hardware... dopoemettere lettere di avvertimento a molte società di e-liquid nazionali non conformi— non fa automaticamente presagire male per altri produttori. Pochissimi produttori di hardware cinesi vendono i loro prodotti direttamente ai consumatori, come fa Sigelei. E si spera che nessuno degli altri produttori di dispositivi pubblicizzi i propri prodotti come "sicuri per il PMTA", quando in realtà il loro PMTA è stato rifiutato più di un anno fa.
Molte aziende, inclusi alcuni produttori di hardware cinesi, hanno PMTA ancora in attesa di revisione. La FDA non ha mostrato alcuna inclinazione a perseguire l'applicazione contro tali aziende. In effetti, se la FDA avesse voluto inviare un messaggio audace all'industria cinese dello svapo, sembra probabile che l'agenzia avrebbe scelto un marchio più popolare e visibile da usare come esempio.